Nota Bene !
I termini sottolineati e alcune immagini contengono dei collegamenti ad altre pagine web.
Accanto al titolo della pagina principale ci sono i collegamenti alle sottopagine.
Commenti e richieste
Se avete qualcosa da chiedere, precisare o commentare, lasciate un messaggio (cliccando sulla voce commenti e richieste).
DIRITTI.
Questo sito non rappresenta una testata giornalistica in quanto viene aggiornato senza alcuna periodicità. Non può pertanto considerarsi un prodotto editoriale ai sensi della legge n. 62 del
7.03.2001. Alcune delle foto presenti su questo blog sono state reperite in internet: i link sono visibili, dove presenti sono state lasciate le firme degli autori, chi ritenesse danneggiati i
suoi diritti d'autore puo' contattarmi per chiederne la rimozione.
Classi Prime: SCIENZE DELLA TERRA
La Scienza e il metodo scientifico o metodo sperimentale
Le scienze naturali sono una delle due branche della scienza (l'altra sono le scienze sociali), che comprendono lo studio degli aspetti fisici, chimici e biologici della Terra, dell'Universo e delle varie forme di vita, uomo incluso. Possono essere suddivise in scienze della terra e scienze della vita (scienze biologiche o Biologia).
Le scienze sono suddivise in molte specializzazioni, ognuna studia fenomeni diversi. Ad esempio la botanica è una scienza che studia le piante; la zoologia è una scienza che studia gli animali; l’anatomia è una scienza che studia il corpo umano; la geologia è una scienza che studia la terra; la chimica è una scienza che studia come sono fatte le sostanze e come si possono trasformare; ecc... .
In genere le scienze naturali hanno lo scopo di capire i fenomeni che possiamo osservare nell'universo usando il metodo scientifico o metodo sperimentale, ovvero la formulazione di ipotesi sulla base dei dati raccolti sul campo (vale a dire sul luogo dove avviene il fenomeno), da cui discendono la creazione e la verifica di modelli sperimentali.
Quando uno scienziato studia un determinato fenomeno segue un preciso percoso:
Il punto di partenza: l’osservazione genera domande
1) Osserva il fenomeno naturale che ha deciso di studiare.
2) Raccoglie tutti i dati possibili sul fenomeno, usando quando possibile appositi strumenti di misurazione.
3) Ordina e studia i dati raccolti, cercando di trovare una spiegazione facendo riferimento, anche, a conoscenze, modelli e teorie precedenti. Cerca di trovare dei collegamenti con altri fenomeni e vede se è possibile fare delle previsioni su ciò che potrebbe accadere.
4) Formula un’ipotesi per spiegare il fenomeno.
5) Esegue un esperimento per verificare l’ipotesi.
6) Registra e analizza i risultati dell’esperimento.
7) Verifica se l’ipotesi è confermata dall’esperimento, che può anche ripetere per essere più sicuro e controlla se le previsioni e i collegamenti, ipotizzati in precedenza sono esatti.
8) Formula una conclusione elaborando, se
possibile, una legge generale (qualcosa che si può esprimere attraverso una formulazione matematica) o un modello (una possibile rappresentazione del fenomeno). Un modello rappresenta un legame
tra la realtà e la teoria.
Quando un’ipotesi viene confermata dagli esperimenti, lo scienziato può formulare una teoria generale, che spiega non solo il fenomeno osservato, ma tutti i fenomeni dello stesso tipo che saranno
osservati anche in futuro.
9) Se la conclusione coincide con l’ipotesi lo studio è finito. Se la conclusione non coincide con l’ipotesi ricomincia dal punto 2, cioè formula una nuova ipotesi.
10) Pubblicazione dei risultati. Anche questo è un passaggio importante, perché anche gli scienziati possono commettere degli errori (a volte in buona fede a volte in malafede); se gli altri scienziati, ripetendo gli esperimenti otterranno gli stessi risultati, e arriveranno alle medesime conclusioni, allora la teoria formulata si imporrà come un fatto scientifico.
LA SCIENZA NON DA MAI NULLA PER DEFINITIVO E SCONTATO
La Scienza non da certezze ma possibili interpretazioni di ciò che osserviamo.
La storia della scienza ci insegna che le teorie scientifiche non sono mai definitive e certe, ma vanno incontro a continui cambiamenti, riformulazioni e verifiche. Il fatto stesso che le teorie provengano da osservazioni ed esperimenti implica che esse devono sempre essere sottoposte a nuove prove, e che un giorno possano essere messe in discussione da ulteriori osservazioni e sperimentazioni.
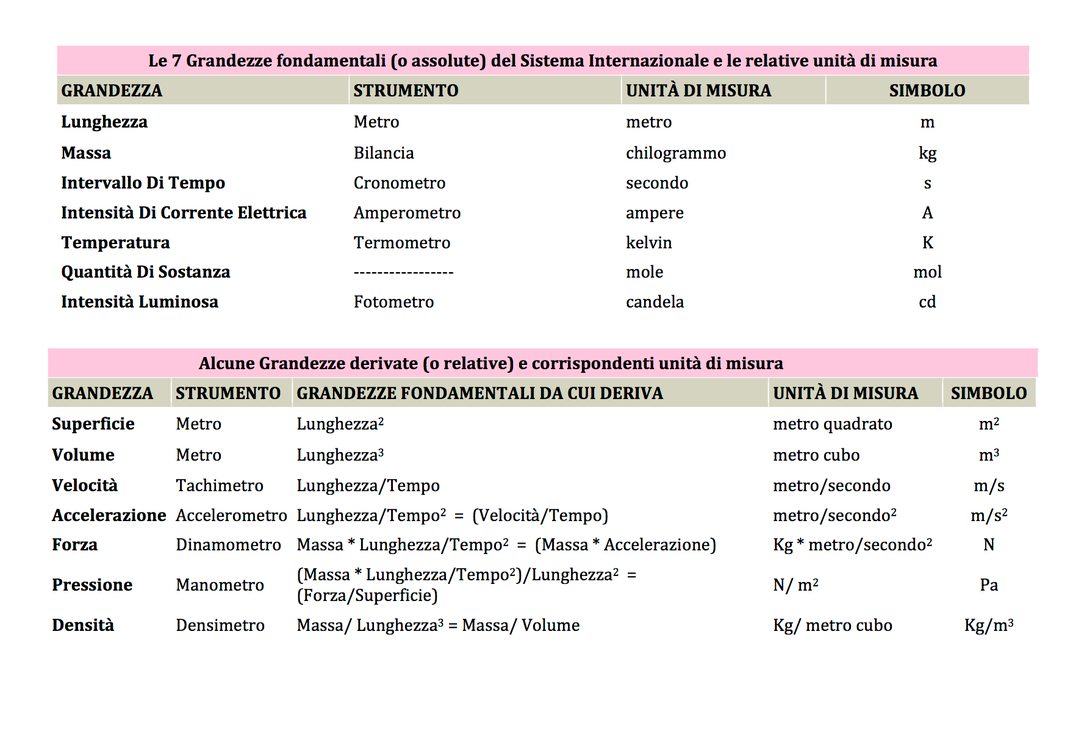
Le grandezze fisiche
Che cos’è una grandezza fisica?
Una grandezza fisica è un ente che può essere misurato con uno strumento di misura. Misurare una grandezza vuol dire associare a quella grandezza un numero, detto misura della grandezza.
Le grandezze fisiche - Digilander Libero

Alcune grandezze fisiche derivate

Altri modi di classificare le grandezze fisiche
GRANDEZZE ESTENSIVE ED INTENSIVE
Le grandezze fisiche (densità, massa, peso, volume, lunghezza, ecc.) possono essere classificate in grandezze intensive e grandezze estensive.
Grandezze estensive
Sono grandezze estensive quelle che dipendono dalla quantità di materia(cioè dalla massa e quindi dalle dimensioni del campione).
Esempi di grandezze estensive sono: massa, volume, lunghezza, area, entropia, entalpia, quantità di calore, energia.
Ad esempio cinque litri di acqua occuperanno un volume (uno spazio) maggiore di due litri di acqua.
Grandezze intensive
Sono grandezze intensive quelle che non dipendono dalla quantità di materia (cioè dalla massa e quindi non dipendono dalle dimensioni del campione).
Esempi di grandezze intensive sono: temperatura di ebollizione, temperatura di fusione, densità, peso specifico, calore specifico, molarità, normalità, pressione.
Ad esempio cinque litri di acqua possono avere una temperatura inferiore a quella di due litri di acqua.
GRANDEZZE SCALARI E GRANDEZZE VETTORIALI
Sono dette grandezze scalari, quelle che, come per esempio la distanza tra due punti, la temperatura o il tempo, risultano completamente definite da un numero, che ne rappresenta il valore. Per descrivere completamente una grandezza scalare è quindi sufficiente indicare un valore numerico accompagnato dalla relativa unità di misura (la distanza tra due oggetti è pari a 5 metri, la temperatura di una pentola piana di acqua è di 60 °C ecc.). Il valore del numero che definisce la misura di una grandezza scalare viene indicato con il termine di modulo, o più frequentemente intensità.
Sono definite grandezze vettoriali quelle che per essere descritte necessitano, oltre che di un'intensità, anche di una direzione e di un verso. Sono esempi di grandezze vettoriali la velocità e la forza. Per avere un'informazione completa sulla velocità di un'automobile, per esempio, si potrà dire che viaggia a 140 (modulo) km/h, percorrendo l'autostrada Salerno – Reggio Calabria (la sua direzione), in direzione di Salerno (il verso).
Sono definiti uguali due vettori che hanno lo stesso modulo, la stessa direzione e lo stesso verso; sono definiti opposti due vettori che hanno lo stesso modulo e la stessa direzione, ma verso opposto.
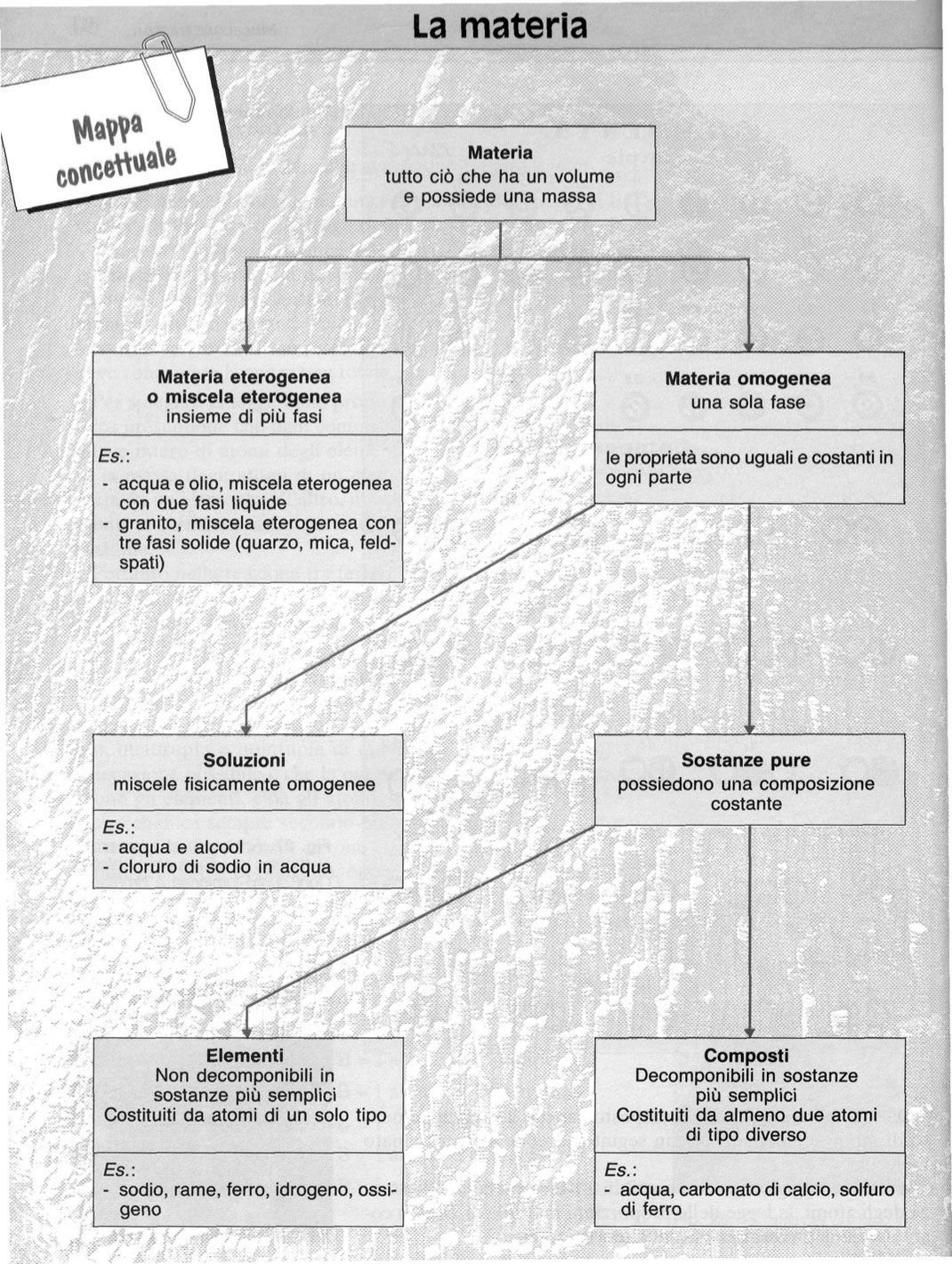
La materia
Materia è tutto ciò che occupa spazio: le gocce d'acqua e le particelle di polvere sono tipi di materia, così come le piante, gli
animali, i pianeti.
La materia ha una massa, che è una misura delle particelle (atomi e molecole) di cui è costituita.
Tali particelle possono aggregarsi in modi diversi, realizzando strutture diverse: per questo esistono molti tipi di oggetti
materiali.
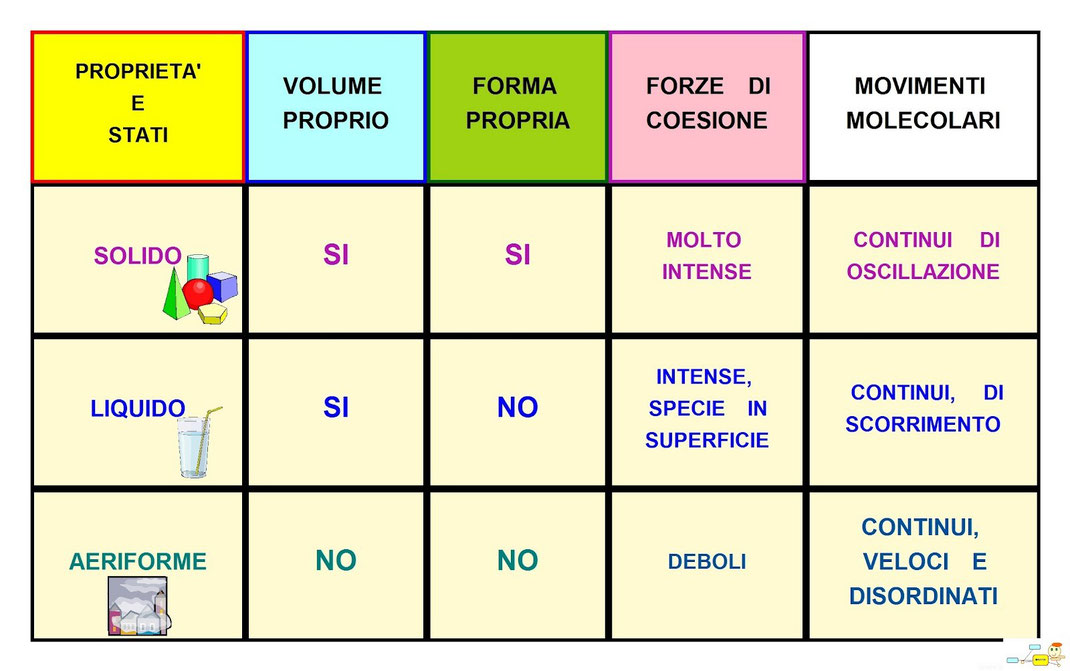
Tutte le forme di materia possono trovarsi però in tre soli stati: solido, liquido o gas.
Un'altra proprietà della materia è l'INERZIA:
l'nerzia è la proprietà che hanno i corpi ad opporsi a qualsiasi variazione del loro stato di moto o di quiete.
La massa di un oggetto è quindi caratterizzata da due diverse proprietà e quindi distingueremo tra:
MASSA INERZIALE: resistenza di un corpo fermo ad essere accelerato o se in movimento ad essere fermato o deviato;
MASSA GRAVITAZIONALE: la capacità di un corpo di attrarre altri oggetti (gravità).
Le due proprietà sono collegate perchè la massa gravitazionale di un corpo è direttamente proporzionale alla sua massa inerziale e viceversa.
CARATTERISTICHE GENERALI DEI DIVERSI STATI DI AGGREGAZIONE DELLA MATERIA
CARATTERISTICHE GENERALI DEI DIVERSI STATI DI AGGREGAZIONE DELLA MATERIA
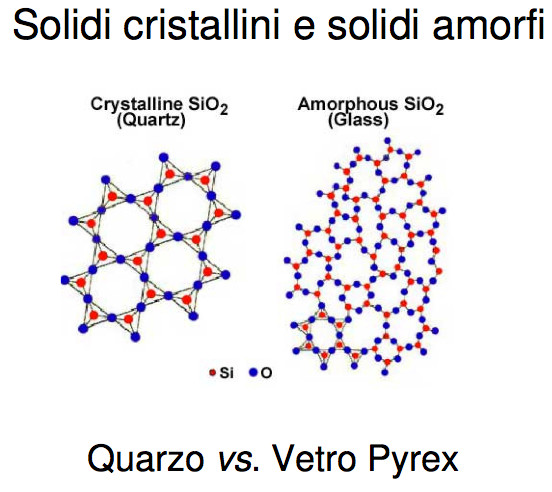
STATO SOLIDO: esistono due tipi di solidi - Solidi cristallini e solidi amorfi
Solidi cristallini: le particelle sono disposte regolarmente nello spazio.
Solidi amorfi: le particelle sono disposte irregolarmente nello spazio.
Nello stato solido le particelle sono sono a stretto contatto tra di loro e legate con legami forti, occupano posizioni fisse (cioè non possono spostarsi con facilità dalle posizioni che occupano).
Questo comporta che, nello stato solido, i corpi hanno forma propria (sono rigidi) e volume proprio (sono incomprimibili).
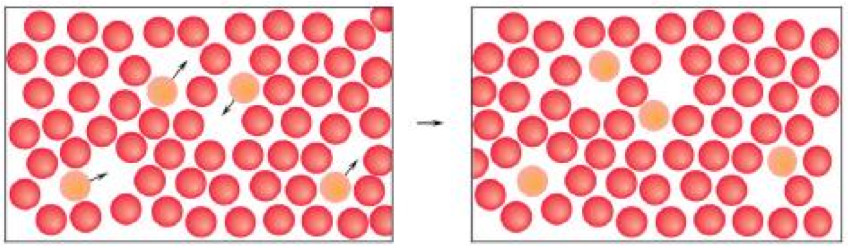
STATO LIQUIDO: Nello stato liquido le particelle sono sono a stretto contatto tra di loro ma legate con legami deboli, non occupano posizioni fisse (cioè possono spostarsi con facilità dalle posizioni che occupano).
Questo comporta che, nello stato liquido, i corpi non hanno forma propria ma assumono la forma del recipiente che li contiene (non sono rigidi le particelle si possono spostare le une rispetto alle altre). Hanno volume proprio (sono incomprimibili) come i solidi perché le particelle sono a stretto contatto l’una con l’altra.
STATO aeriforme (gassoso): Nello stato aeriforme le particelle sono non sono a stretto contatto tra di loro, le forze di attrazione sono estremamente deboli, quindi non occupano posizioni fisse (possono spostarsi con facilità l’una dall’altra, occupando tutto lo spazio a loro disposizione).
Questo comporta che, nello stato aeriforme, i corpi non hanno forma propria ma assumono la forma del recipiente che li contiene (non sono rigidi le particelle si possono spostare molto facilmente le une rispetto alle altre). Non hanno volume proprio (sono comprimibili) (a differenza dei solidi e dei liquidi) perché le particelle non sono a stretto contatto l’una con l’altra ma molto distanti tra loro.
Stato solido
Stato liquido
Stato gassoso
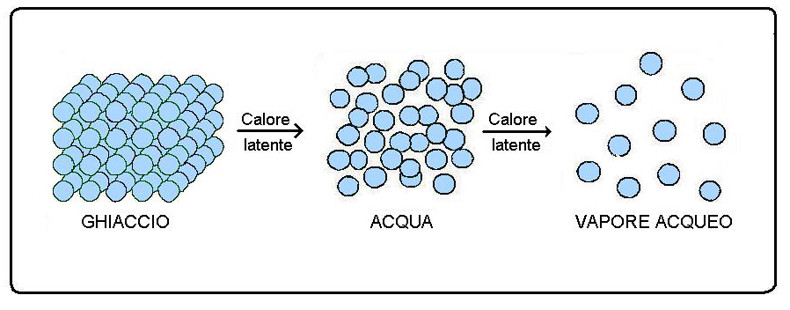
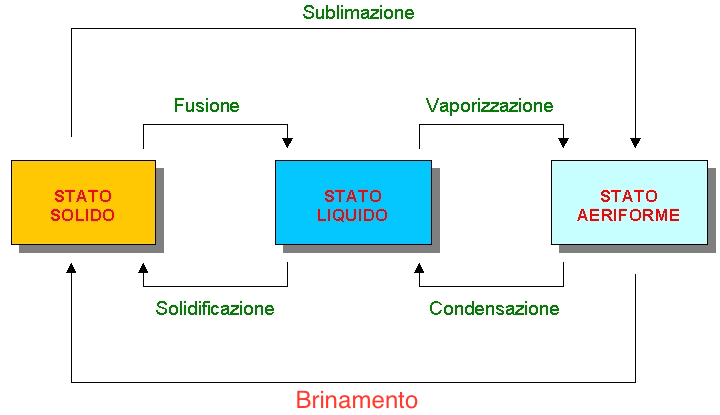
I passaggi di stato
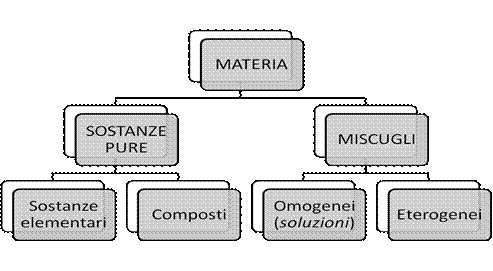
Le sostanze
Quando esaminiamo le diverse forme nelle quali la materia esiste, cioè i vari materiali nella quale ci appare, ci accorgiamo che ogni diverso tipo di materiale presenta proprietà ben definite e quindi per distinguerli l’uno dall’altro useremo, per ogni diverso materiale il nome di sostanza. Sono esempi di sostanze il rame, l'alluminio, il saccarosio, il cloruro di sodio, l'acqua, l'ossigeno. Una sostanza allo stato puro si distingue da un'altra, anch'essa allo stato puro perché possiede proprietà chimiche e fisiche specifiche. Il termine “puro” però, è un'astrazione poiché anche le sostanze pure contengono piccole percentuali di impurità che non ne modificano sensibilmente le proprietà.

Proprietà fisiche specifiche delle sostanze pure (PUNTI FISSI)
Punto di fusione
Punto di ebollizione
Densità
Conducibilità elettrica
Colore
Durezza
Calore specifico
Nomi comuni di alcune miscele eterogenee
Nomi comuni di alcune miscele omogenee
Tecniche fisiche di separazione dei miscugli
- Le miscele possono avere proporzioni variabili, essere separate fisicamente e conservano le proprietà dei loro componenti.
- Quando una miscela viene separata nei suoi componenti, si dice che i composti sono stati purificati.
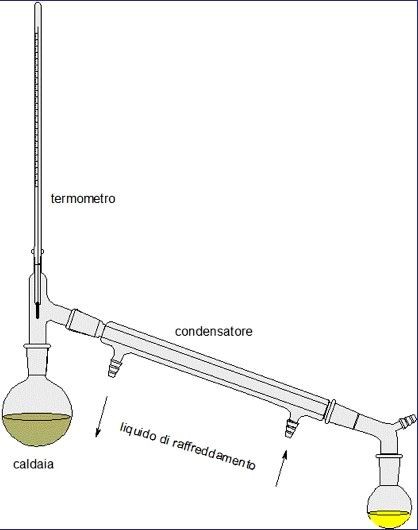
- I processi di separazione fisica comprendono: la filtrazione, la cristallizzazione, l’estrazione, la cromatografia e la distillazione.
Filtrazione: separa i componenti di una miscela sulla base di differenze tra le dimensioni delle particelle.
Cristallizzazione: si basa su differenze di solubilità.
Distillazione: separa i componenti di una miscela sulla base della differente volatilità, ossia la tendenza di una sostanza a trasformarsi in un gas (differenti punti di fusione ed ebollizione dei componenti la miscela).
Estrazione: si basa su differenze di solubilità.
Cromatografia: è una tecnica di separazione basata sulla diversa velocità di migrazione (spostamento) con cui più sostanze depositate su su un supporto adatto (carta da filtro, gel di silice o di alluminio, ecc.), vengono trasportate da un fluido detto eluente e si stratificano in posizioni differenti sul supporto. La cromatografia permette quindi la separazione e la purificazione di miscele anche molto complesse di sostanze inorganiche ed organiche.
Domande della verifica sulle grandezze fisiche
1. La comprimibilità è una caratteristica di quale stato fisico della materia?:
2. Un elemento come viene definito?
3. I gas: -- non hanno volume proprio e hanno forma propria -- non hanno forma propria e hanno volume proprio -- non si comprimono -- hanno forma e volume propri -- non hanno forma e volume propri
4. Un composto come viene definito?
5. Il passaggio diretto dallo stato solido allo stato di vapore è detto:
6. Il Sistema Internazionale delle Unità di Misura si basa su quante grandezze assolute?
7. Quando una grandezza si dice fondamentale?
8. La lunghezza è una grandezza fondamentale?
9. Quali sono le grandezze fondamentali?
10. La massa che un corpo possiede è una costante o varia al variare delle situazioni?:
è una costante del corpo.
11. L'unità di misura della massa nel sistema internazionale è ?
12. L'unita di misura della intensità di corrente elettrica nel sistema internazionale è:
13. L'unità di misura della temperatura nel sistema internazionale è:
14. L'unità di misura della intensità luminosa nel sistema internazionale è:
15. Un sistema è eterogeneo quando è costituito da due o più fasi?
16. I liquidi e gli aeriformi costituiscono i fluidi - si
17. Lo stato fluido ha forma propria? no
18. L’aria è un composto? No è una miscela omogenea di più gas
19. La massa di un corpo può essere creata dal nulla - no
20. La temperatura di un corpo misura – l’energia cinetica media delle particelle che costituiscono un corpo (l’energia cinetica è l’energia associata al movimento)
21. La densità è una grandezza assoluta? no
22. La massa di un corpo è una proprietà della materia che si conserva. Si
23. La massa di un corpo è il rapporto tra la sua densità e il suo volume. No è il rapporto tra massa e volume.
24. Nel S.I. l'unità di misura della massa è il grammo – no il Kg
25. La massa è una grandezza fisica invariante (non varia con il variare della temperatura o della pressione) - vero
26. La massa si misura con la bilancia a due braccia?
27. A 4° C 1 L di acqua ha una massa di 1 kg? Si
28. La massa e il volume di un corpo sono grandezze direttamente proporzionali. (cioè se aumenta una aumenta anche l’altra grandezza) – si
29. La densità di un corpo sulla Luna è diversa da quella che lo stesso corpo ha sulla Terra – no
30. Il S.I. (Sistema Internazionale delle misure) è: il sistema di misura utilizzato universalmente per le sette grandezze fisiche fondamentali
31. La densità è una grandezza derivata che esprime: la quantità di materia di cui è costituito un corpo
32. La relazione che consente di ricavare la forza dalla pressione e dalla superficie è: F = P *S - si
33. La massa di 100 Kg di ferro è ............................... di quella di 100 Kg di acqua. – sono uguali
34. L'energia può essere creata dal nulla? No
35.Che cos’è l’energia? tutto ciò che può produrre lavoro
36. Lo stato di aggregazione dipende dalla pressione? Si
37. Lo stato di aggregazione dipende dalla temperatura? Si
38. Lo stato di aggregazione dipende dal volume? No
39. I liquidi posseggono volume proprio? Si
40. I solidi possiedono volume proprio? Si
41. I solidi possiedono forma propria? Si
42. I liquidi possiedono forma propria? No
43. I liquidi non possono avere densità elevata – si ad esempio il mercurio
44. I solidi sono praticamente incomprimibili - si
45. I liquidi sono praticamente incomprimibili - si
46. I solidi presentano spesso forme geometriche regolari - si
47. L’attrazione tra le particelle di un solido sono deboli – no sono forti
48. l latte è una miscela eterogenea – si
49. La sabbia è un miscela omogenea – no eterogenea
50. L’anidride carbonica è un composto - si
51. L’acqua minerale è una soluzione - si
52. La temperatura è una grandezza: assoluta ed intensiva (non dipende dalla quantità, in questo caso dalla massa)
53. Che cosa è la massa di un corpo? - la quantità di materia in esso contenuta
54. Quale settore d’attività, tra i seguenti, è più specifico per il chimico? La ricerca di nuovi materiali (sostanze)
55. Un campione è omogeneo quando ha un aspetto e una composizione uniformi? Si
56. La temperatura misura l’energia cinetica media delle particelle – si
57. Che cosa è una trasformazione chimica? - la trasformazione di una sostanza in un’altra sostanza
58. Qual’è una definizione corretta di elemento ? l’elemento non può essere ulteriormente suddiviso in altre sostanze
59. I gas: non hanno volume proprio e non hanno forma propria
60. La temperatura di ebollizione dell'acqua a 3000 metri di altitudine rispetto a quella del livello del mare: è minore, perché diminuisce al diminuire della pressione e a 3000 metri la pressione è minore che a livello del mare.
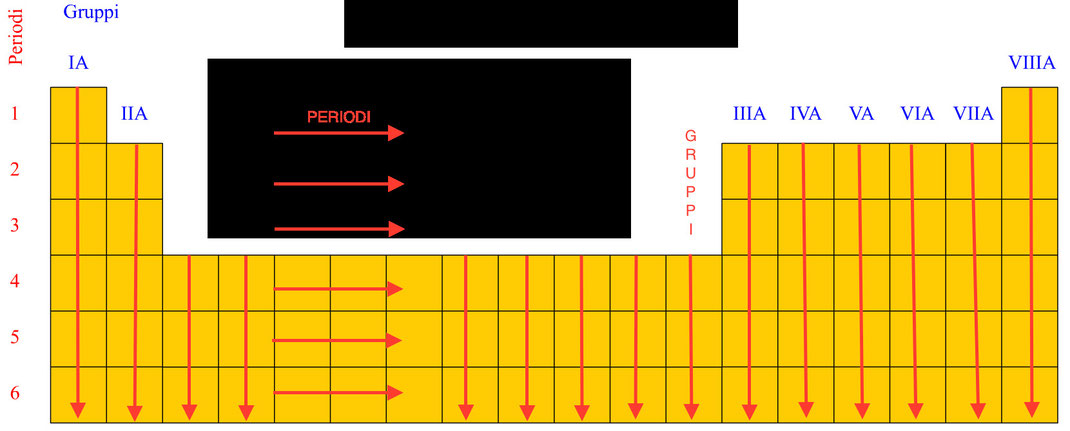
LA CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI CHIMICI
Per poter comprendere le proprietà chimiche degli elementi e per prevedere il loro comportamento è necessario ordinarli secondo una qualche proprietà.
Gli elementi chimici si possono classificare nei due grandi gruppi dei metalli. dei non metalli e dei semimetalli:
1. I metalli sono lucenti e si presentano allo stato solido a temperatura ambiente (con la sola eccezione del mercurio che a questa temperatura è liquido). Gli elementi metallici sono malleabili e duttili, ovvero possono essere lavorati e ridotti in lamine o fili sottili. Inoltre sono buoni conduttori di calore ed elettricità.
2. I non metalli, al contrario, non sono lucenti e sono spesso incolori. A temperatura ambiente se ne trovano 11 allo stato gassoso, come l’ossigeno e l’azoto, 15 allo stato solido, come il carbonio, il fosforo, lo zolfo e lo iodio e soltanto 1 allo stato liquido, il bromo. Qualora siano solidi, non sono malleabili. Infine i non metalli sono isolanti, ovvero sono dei cattivi conduttori di calore ed elettricità.
3. I semimetalli sono elementi che possiedono proprietà fisiche intermedie tra quelle dei metalli e quelle dei non metalli. Alcuni semimetalli presentano una lucentezza metallica, ma sono in genere più fragili e poco duttili. Vi sono poi alcuni di questi elementi la cui conducibilità varia a seconda della temperatura.
Nel 1869, il chimico russo Dmitrij Ivanovič Mendeleev propose una “classificazione degli elementi” di fondamentale importanza. Dopo aver determinato la massa atomica di tutti gli elementi, Mendeleev prese in considerazione le formule dei loro composti con l’ossigeno e con il cloro e alcune proprietà fisiche, come la densità, la durezza e il punto di fusione. Egli ordinò i 63 elementi conosciuti secondo la loro massa atomica crescente, disponendoli in file (righe orizzontali) e incolonnandoli (colonne verticali) quando presentavano proprietà simili. Apparve evidente che le proprietà degli elementi si ripetevano con regolarità periodica e ordinata, per cui tale disposizione prese il nome di tavola periodica degli elementi.
Come detto, gli elementi che appartengono allo stesso gruppo hanno proprietà chimiche simili (non uguali !).
Oggi gli elementi chimici sono invece disposti in ordine di numero atomico crescente (più avanti vedremo il significato dei
termini: massa atomica e numero atomico).
L’ATOMO

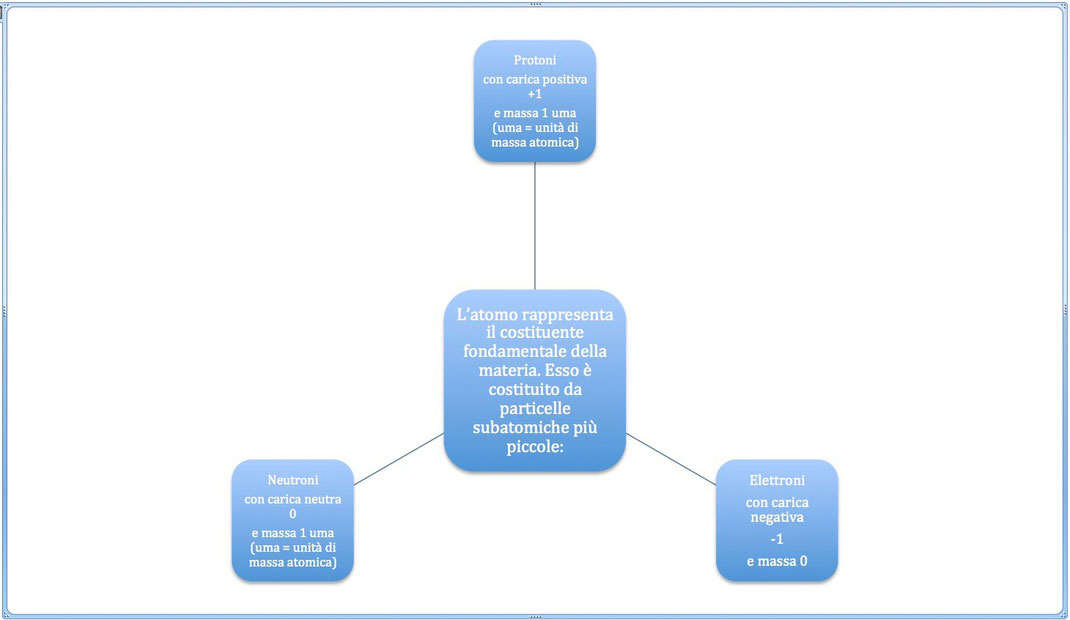
L’atomo rappresenta il costituente fondamentale della materia. Esso è costituito da particelle subatomiche più piccole:
protoni, dotati di carica elettrica positiva (+1); neutroni (0), privi di carica elettrica; elettroni (-1), dotati di una carica elettrica negativa.
Le particelle con massa maggiore, protoni e neutroni, sono localizzate in un nucleo molto piccolo che contiene le cariche positive e nel quale è concentrata tutta la massa dell’atomo. Gli elettroni, con massa minore (quindi trascurabile), circondano il nucleo e occupano la maggior parte del volume dell’atomo. Le proprietà chimiche degli elementi e delle molecole dipendono in gran parte dagli elettroni.
Numero atomico, numero di massa e unità di massa atomica

Il numero atomico (Z) di un elemento è uguale al numero dei protoni presenti nel nucleo dell’elemento stesso. In un atomo che presenta una carica elettrica uguale a zero il numero di elettroni, sarà uguale a quello dei protoni e quindi al numero atomico. Il numero atomico, poiché è caratteristico di ogni elemento, permette l’identificazione dell’elemento stesso.

Il numero di massa (A) è dato dalla somma del numero dei protoni e del numero dei neutroni presenti nel nucleo dell’atomo (l'elettrone ha una massa 1836 volte più piccola di quella del protone e quindi non si somma alla massa dell'atomo essendo trascurabile). Si può identificare un elemento conoscendo il suo numero atomico e il suo numero di massa.
Le masse delle particelle atomiche vengono espresse in unità di massa atomica (uma). L’unità di massa atomica rappresenta un modo per descrivere la massa relativa degli atomi.
Gli Isotopi
Due atomi con lo stesso numero atomico (quindi con lo stesso numero di protoni), ma con diverso numero di neutroni nel nucleo (quindi con massa atomica diversa), sono chiamati isotopi. Perciò questi due atomi avendo lo stesso numero di protoni saranno atomi appartenenti allo stesso elemento, quello che distingue è la massa atomica (A) cioè il diverso numero di neutroni.
Gli isotopi di uno stesso elemento avranno, quindi, le stesse proprietà chimiche (che dipendono dagli elettroni e in un atomo neutro sono uguali, come numero, ai protoni), ma avranno diverse proprietà fisiche come la densità.
Per indicare i numero atomico e la massa atomica di un atomo vengono usati dei simboli particolari come si può vedere sopra:
L’idrogeno (H) nella forma più presente in natura (99,9%) ha Z=1 e A=1, cioè soltanto un protone e un elettrone, e prende anche il nome (in disuso) di prozio. Esso possiede due isotopi principali: il deuterio (A=2), presente allo 0,015% e il trizio (A=3), presente in tracce.
I tre isotopi principali dell’idrogeno. Da sinistra a destra: prozio, deuterio e trizio. (Autore: Dirk Hünniger)
Alcuni isotopi sono instabili e tale instabilità è alla base di cambiamenti a livello subatomico che possono liberare energia, sotto forma di radiazioni. In questo modo possono anche decadere, ovvero raggiungere una forma più stabile (a minore energia) o addirittura trasformarsi in un altro elemento, spesso più leggero. Questi isotopi vengono definiti radioattivi. Questo passaggio da una forma meno stabile (“più radioattiva”) a una più stabile è misurabile e prende il nome di tempo di dimezzamento (o emivita): il tempo impiegato da un isotopo radioattivo affinché metà degli atomi presenti in un campione generico decadano in una forma più stabile (o in un altro elemento).
Un isotopo molto noto è il carbonio-14 (14C), il quale con un tempo di dimezzamento di circa 5700 anni, si trasforma in 14N. Viene utilizzato in archeologia per datare reperti di origine organica (contententi per l’appunto carbonio), come per esempio fibre tessili naturali o reperti fossili animali e vegetali.
Gli Ioni
Come abbiamo già detto protoni e neutroni sono localizzati nel nucleo dell’atomo e sono legati tra loro con una forza enorme molto difficile da rompere (la funzione dei neutroni è proprio quella di tenere legati tra loro i protoni in quanto cariche dello stesso segno si respingono tra loro, così come si respingono i poli uguali di una calamita, mentre cariche dello stesso segno si attraggono).
Questo vuol dire che, in condizioni normali, non possiamo separare tra loro le particelle che costituiscono il nucleo dell’atomo. Gli elettroni, che invece orbitano intorno al nucleo, sono legati ad esso con una forza molto più debole e quindi si possono staccare dall’atomo. Naturalmente, se un atomo perde un elettrone ci sarà un altro atomo che lo acquista.
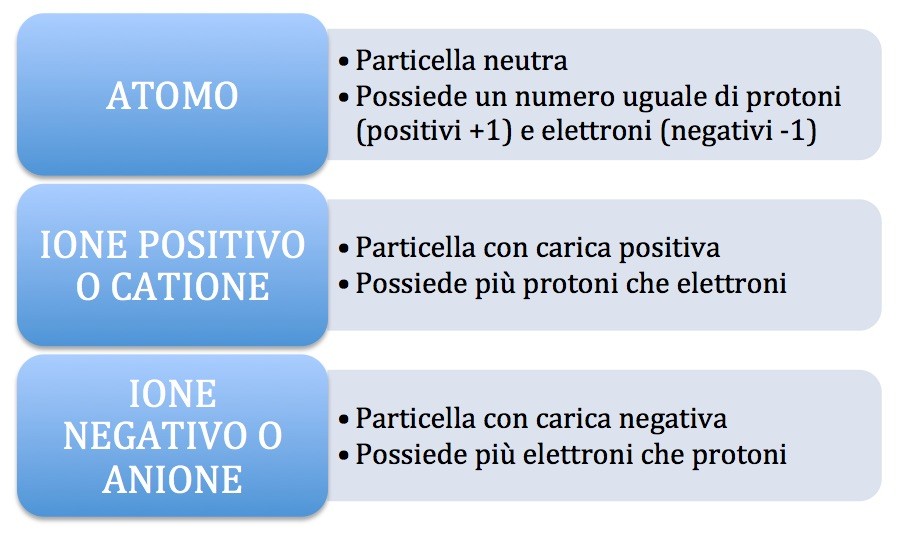
Abbiamo già detto che un atomo non è carico elettricamente perché protoni e elettroni sono presenti nello stesso numero e quindi facendo la somma delle cariche positive (i protoni) e delle cariche negative (gli elettroni) la carica complessiva di un atomo sarà pari a zero. Quando però un atomo perde un elettrone, essendo gli elettroni carichi negativamente (-1) l’atomo che l’ha perso non sarà più neutro perché avrà più protoni che elettroni, più cariche positive che negative e di conseguenza sarà carico positivamente. Viceversa, l’atomo che ha acquistato l’elettrone avrà una carica negativa in più avendo, adesso, più elettroni che protoni perciò sarà carico negativamente.
Quando un atomo non è più neutro perché ha perso o acquistato elettroni, viene chiamato ione: ione positivo o catione se ha più protoni che elettroni e ione negativo o anione se ha più elettroni che protoni.
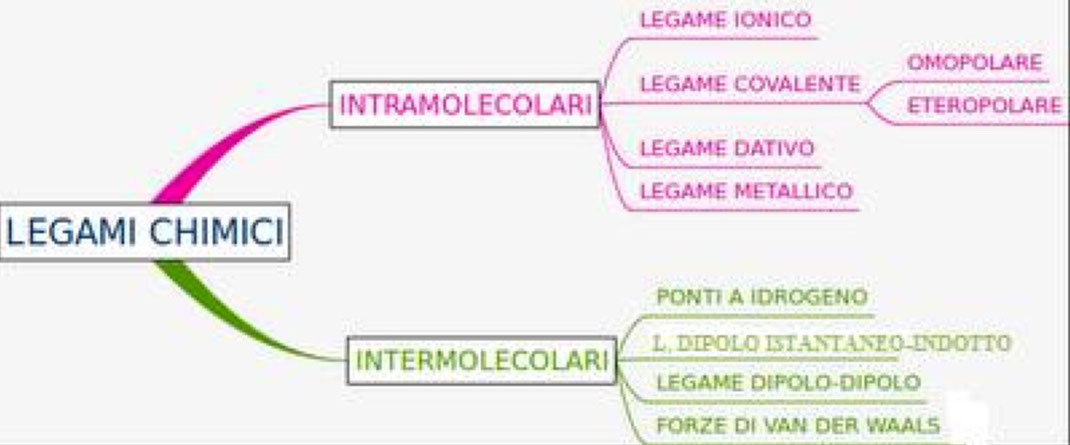
I legami chimici
Tutti gli atomi, a parte i gas nobili, che nella Tavola Periodica occupano l’ultima colonna a destra, non possono esistere isolati gli uni dagli altri, devono quindi unirsi tra loro per formare delle molecole o degli aggregati, questo succede perché gli elettroni intorno al nucleo sono distribuiti all’interno di gusci concentrici, secondo un determinato schema.
All’interno del primo guscio, quello più vicino al nucleo, possono essere ospitati massimo due elettroni, nel secondo guscio otto, nel terzo otto, nel quarto diciotto, nel quinto diciotto, nel sesto trentadue, nel settimo trentadue. Questi sette gusci sono sufficienti a contenere anche gli elettroni dell’atomo più grande finora scoperto l’atomo, al quale non è stato ancora assegnato un nome, che ne ha 116 chiamato, livermorio con Z=116 e A=282 (116 protoni, 116 elettroni e 166 neutroni).
Quando un atomo ha un numero di elettroni sufficienti a riempire completamente un guscio, diventa particolarmente stabile e non si lega agli altri atomi per formare delle molecole, esisterà come atomo isolato e quindi come gas. Questo è quello che succede con i gas nobili, che appartengono all’ultimo gruppo a destra della Tavola Periodica.
Tutti gli altri atomi non possono esistere isolati, non avendo completo il loro guscio elettronico esterno. Per raggiungere questa condizione devono somigliare al gas nobile a loro più vicino come numero atomico (perché vuol dire che avranno in questo modo il guscio elettronico esterno completamente pieno di elettroni).
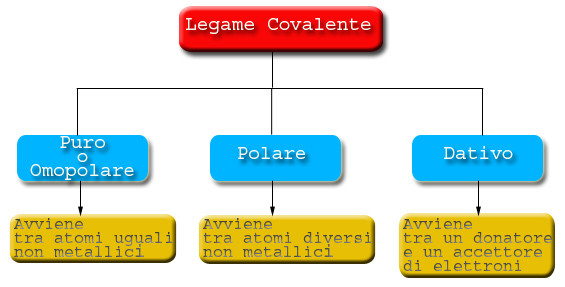
Per riuscire a raggiungere quest’obiettivo, uno dei modi è di cedere elettroni, ad altri atomi (se nel guscio più esterno [o livello energetico più esterno] ne hanno pochi) oppure acquistare degli elettroni, sempre da altri atomi (se nel guscio più esterno [o livello energetico più esterno] ne hanno tanti e ne mancano pochi per completarlo). Oppure, esiste ancora un’alternativa che è quella di condividere gli elettroni del guscio più esterno, in modo che tutti gli atomi, coinvolti nel legame chimico, grazie agli elettroni condivisi raggiungano l’obbiettivo di riempire il livello più esterno. Tra due soli atomi possono essere condivisi massimo tre coppie di elettroni. Quando gli elettroni vengono condivisi si parla di legame covalente.
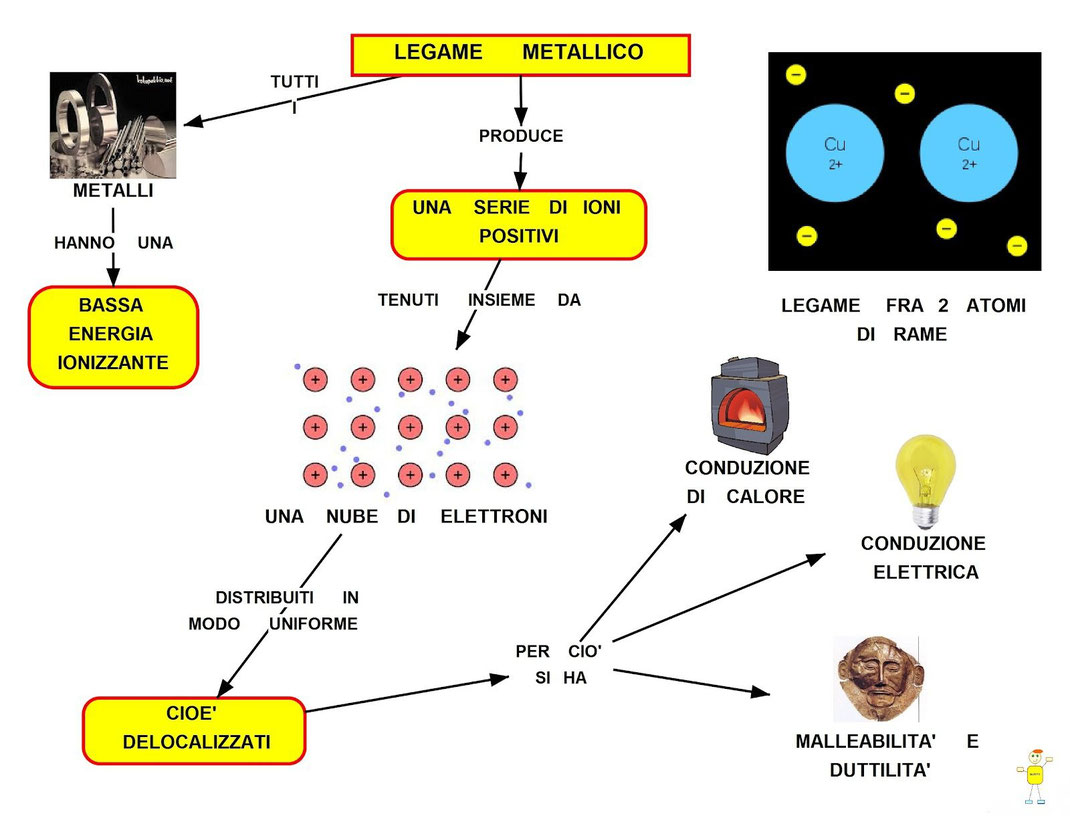
Gli atomi che hanno pochi elettroni nel guscio più esterno sono quelli dei metalli e quindi tendono a cederli, mentre i non metalli ne hanno molti e tendono ad acquistarli.
Quando si legano un metallo e un non metallo, l’atomo metallico cede elettroni al non metallo e quindi diventerà uno ione positivo, mentre l’atomo del non metallo che acquista l’elettrone o gli elettroni diventerà ione positivo. Tra i due ioni quello metallico positivo e quello non metallico negativo si crea una forza di attrazione, visto che hanno cariche opposte (come tra i poli opposti di due calamite), il legame che si viene a formare si chiama legame ionico, perché si crea tra due ioni con carica opposta.
La condivisione di elettroni, può avvenire solo tra atomi di non metalli, infatti, i metalli dovrebbero condividere molti più elettroni, per riempire completamente i loro gusci e ciò non è possibile, avviene invece una condivisione particolare, nella quale gli elettroni vengono condivisi, non tra due tre o quattro atomi, ma bensì tra tutti gli atomi che costituiscono il corpo metallico cioè centinaia di milioni di miliardi di atomi. In questo modo gli elettroni, nei metalli, non sono vincolati e possono orbitare attorno a qualsiasi atomo che fa parte del corpo metallico. Questo tipo di legame è detto legame metallico. Ecco spiegato perché i metalli sono buoni conduttori di elettricità, che è un flusso di elettroni. Nel legame covalente gli elettroni non possono spostarsi facilmente dagli atomi che li condividono, e lo stesso vale per il legame ionico, invece nel legame metallico possono farlo in quanto gli elettroni, come abbiamo detto, non sono condivisi tra due, tre o quatto atomi, ma bensì tra tutti gli atomi del metallo e quindi possono spostarsi con facilità da un atomo all’altro.
Anche le molecole si attraggono tra loro ma più debolmente di quanto si attraggono tra loro due o più atomi, per questo vengono
definiti legami deboli o intermolecolari.
Riassumendo:
Quando si forma un LEGAME TRA UN METALLO E UN NON METALLO il legame vinene detto LEGAME IONICO.
Quando si forma un LEGAME TRA UN NON METALLO E UN ALTRO NON METALLO il legame vinene detto LEGAME COVALENTE.
Quando si forma un LEGAME TRA UN METALLO E UN ALTRO METALLO il legame vinene detto LEGAME METALLICO.
Facciamo qualche esempio, tra due o tra miliardi di atomi di ferro essendo metalli i legami che si creano sono legami metallici.
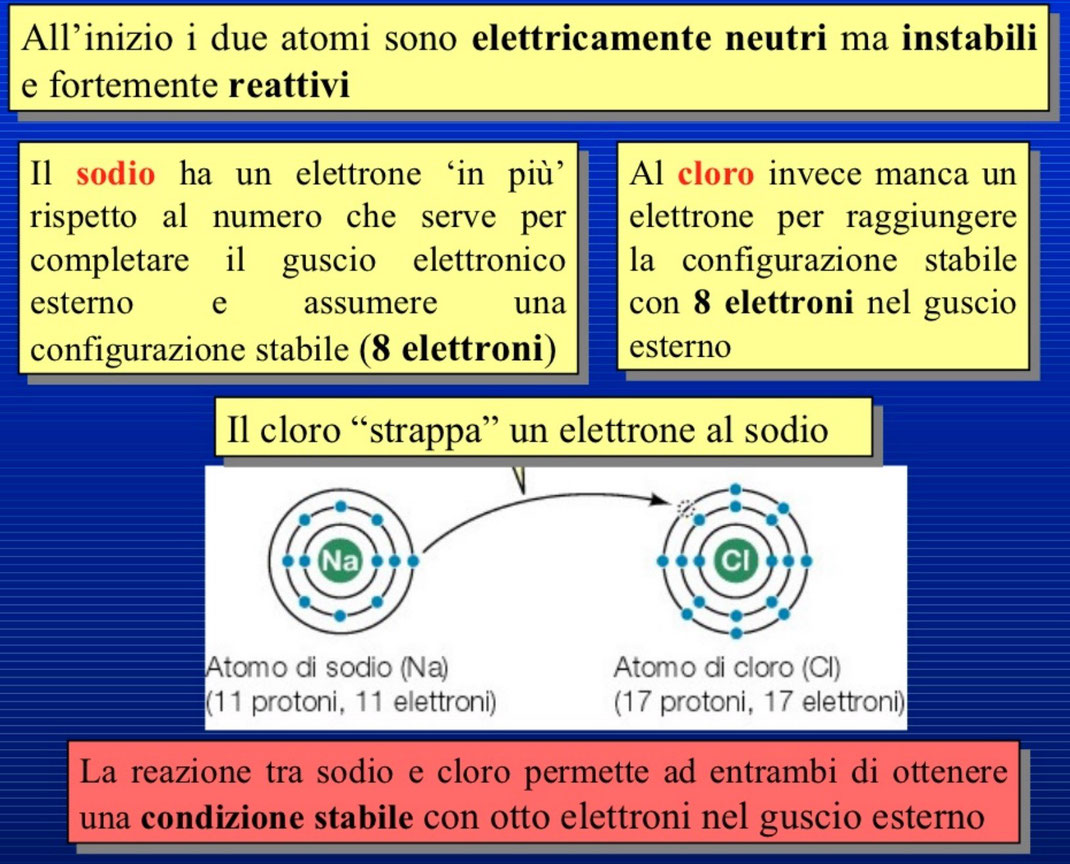
Cosa succede quando si incontrano un atomo di Sodio (un metallo) e un atomo di Cloro (un non metallo)? L’atomo di Sodio ha numero atomico Z = 11, vuol dire che ha 11 protoni e 11 elettroni, come si distribuiranno gli elettroni intorno al nucleo nei vari gusci? Il primo guscio può contenere massimo 2 elettroni, il secondo 8 e il terzo 8. Come possiamo immaginare i primi due elettroni del Sodio riempiranno il primo livello, 11 – 2, ne restano 9, di questi nove 8 riempiranno il secondo guscio e quello che resta si disporrà nel terzo livello. Per riempire il terzo livello che ne può contenere 8, al Sodio servirebbero 7 elettroni ma questo è impossibile perché avrebbe pochi protoni per trattenere attorno a se tutti questi elettroni extra (sono i protoni che attraggono gli elettroni attorno al nucleo). È molto più facile, per il Sodio, perdere l’unico elettrone che ha nel terzo livello, perché in questo modo tutti i livelli sottostanti sarebbero pieni, e avrebbe in questo caso la stessa configurazione (cioè lo stesso numero di elettroni) del Neon, che è il gas nobile a lui più vicino e che è stabile. Deve solo trovare un atomo a quale cedere questo elettrone in più.
Vediamo la situazione del Cloro. Ha numero atomico Z = 17, quindi ha (i neutroni non ci interessano) 17 protoni e 17 elettroni. Come si disporranno intorno al nucleo? 2 nel primo guscio, ne restano 15, 8 nel secondo livello e ne restano 7 che andranno a riempire il terzo guscio, ma per riempirlo completamente ne servirebbero 8, perciò gliene manca 1.
Ora, è facile capire che se l’atomo di Sodio e quello di Cloro si incontrano saranno felici di stabilire un legame (chimico), perché il Sodio cederà l’unico elettrone del terzo livello al Cloro che con esso andrà, invece, a riempirlo completamente (il terzo guscio), visto che ne mancava solo uno. Il Sodio perdendo l’elettrone diventa ione positivo, il Cloro acquistandolo ione negativo, le cariche opposte si attraggono ed ecco che si è formato un legame ionico tra un metallo (il Sodio) e un non metallo (il Cloro). Si è così formato il composto NaCl chiamato cloruro di sodio, il comune sale da cucina.
Se invece non ci fossero a disposizione atomi di Sodio, ma solo atomi di Cloro, cosa avverrebbe? Pensiamoci un po’. Come abbiamo
già detto ad ogni atomo di Cloro manca un solo elettrone per riempire il terzo livello e, quindi, nessuno di loro a intenzione di cedere elettroni ad altri. Ma gli elettroni orbitano attorno al
nucleo a velocità enormi, vicine alla velocità della luce (300.000 Km/s – chilometri al secondo), perciò esiste un’altra possibilità, quella di condividere gli elettroni. Quando due atomi di
Cloro formano un legame di questo tipo (legame covalente), uno dei due atomi “presta” all’altro, per un
attimo, uno dei suoi elettroni del guscio più esterno, l’attimo dopo però gli viene restituito e sarà l’altro atomo a prestargli uno dei suoi elettroni. In questo modo, grazie a questi elettroni
condivisi, è come se ognuno dei due atomi avesse attorno a se tutti i gusci pieni di elettroni, come i gas nobili e quindi diventano stabili. Si è venuta a formare, in questo modo la molecola del
cloro Cl2.
Come abbiamo già detto in precedenza, due atomi tra loro possono condividere massimo tre elettroni ciascuno, vale a dire tre
coppie complessivamente. Allo stesso modo quando si formano dei legami ionici, un atomo di un metallo può cedere ad un atomo di un non metallo massimo tre elettroni, e sempre tre elettroni è il
massimo numero di elettroni che, l’atomo di un non metallo può accettare da un metallo.
C’è ancora una cosa da aggiungere, dobbiamo immaginarci i gusci nei quali si dispongono gli elettroni, come dei vagoni di un treno, ed ognuno dei vagoni è suddiviso in diversi scompartimenti (come delle stanzette), in ognuno di questi scomparti, che negli atomi vengono chiamati orbitali possono entrare massimo due elettroni, ma questi due elettroni non possono essere proprio identici, si dice che hanno spin opposti, è un po’ come se questi due elettroni fossero gemelli solo che uno è mancino e l’altro no (uno ruota su se stesso in senso orario e l’altro gemello in senso antiorario).
Quindi il primo guscio che può ospitare massimo due elettroni sarà come un vagone che ha un solo scompartimento. Il secondo livello, che può ospitare massimo otto elettroni, avrà quattro scomparti, il terzo anche quattro scomparti, il quarto e il quinto guscio, che possono ospitare, ognuno, massimo diciotto elettroni saranno suddivisi quindi in nove scomparti ciascuno.
Facciamo ancora un esempio di legame covalente. Un atomo di ossigeno ha numero atomico Z = 8, di questi otto elettroni, due
riempiranno il primo livello e, i sei che rimangono il secondo, che però per riempirsi ha bisogno di ancora due elettroni, ricordiamocelo.
Un atomo di idrogeno ha numero atomico Z = 1, quest’unico elettrone si disporrà nel primo guscio, ma anche questo non è completo
perché ne manca ancora uno. Ecco che, quando un atomo di ossigeno si lega all’idrogeno, si legherà non ad uno ma a due atomi di idrogeno, perché ha bisogno di due elettroni, e visto che
l’idrogeno è un non metallo, non cederà i sui elettroni all’ossigeno ma li condividerà, si formeranno, di conseguenza, due legami covalenti, uno per ciascun atomo di idrogeno, si formerà la
molecola dell’acqua H2O.